类器官行业研究报告
来源:万原点基金 2022-09-02
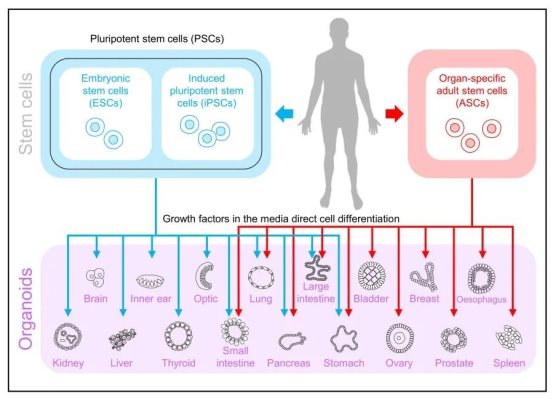
1 类器官技术概要
1.1 基本概念
类器官(Organoids)是指利用成体干细胞或多能干细胞进行体外三维(3D)培养而形成的具有一定空间结构的组织类似物。类器官不是真正意义上的人体器官,但能在结构和功能上模拟真实器官,能够最大程度模拟体内组织结构及功能并能长期稳定传代培养。
类器官在形成过程中再现了体内器官发生的两个事件,即同类细胞以黏附的方式分类聚集和空间特异性的细胞谱系定型。与传统2D细胞培养模式相比,3D培养的类器官包含多种细胞类型,突破了细胞间单纯的物理接触联系,形成了更加紧密的细胞间生物通信,细胞间相互影响、诱导、反馈,协作发育并形成具有功能的迷你器官或组织,在阐明疾病的发展、稳态和发病机制方面更具优势。
类器官形成示意图
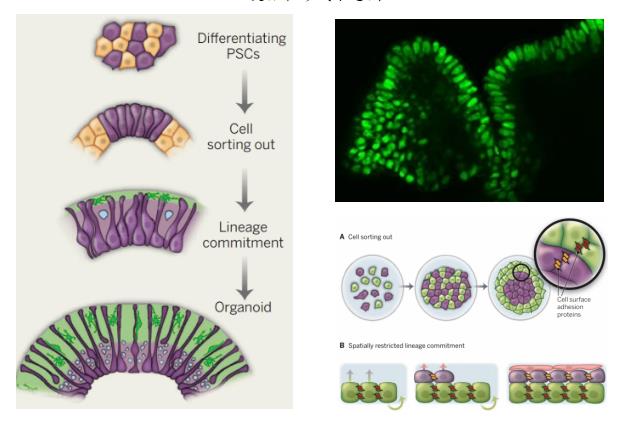
图片来源:M.Lancaster,et al.,Science,2014.,Nat Med,万原点基金整理
类器官通常具备以下几个特征:
(1)必须包含一种以上与来源器官相同的细胞类型;
(2)应该表现出来源器官所特有的一些功能;
(3)细胞的组织方式应当与来源器官相似。
2013年,类器官技术被Science誉为十大科技进展,2017年,被Nature Methods评为生命科学领域的年度技术。 2021年,类器官被列为我国“十四五”国家重点研发计划重点专项。类器官既可用于正常组织模型的建立,也可用于疾病模型的建立,可实现对现有2D培养方法和动物模型系统的高信息量互补。类器官在各大研究领域显示出强大潜力,包括发育生物学、疾病病理学、细胞生物学、再生机制、精准医疗以及药物毒性和药效试验。此外,类器官在基因编辑、细胞疗法、器官移植等方面也具有广阔的前景。
随着近几年微流控、组织工程、材料科学等领域的不断发展,类器官技术也在尝试与这些新兴技术进行融合并创造新的研究应用场景,器官芯片正是在这个背景下诞生的,器官芯片是指在芯片上构建器官生理微系统,通常以微流控芯片为核心,将生物学、材料学以及工程学知识相结合,在体外模拟包含活体细胞、生物流体、机械力刺激等要素的组织器官微环境。
肺器官芯片模型
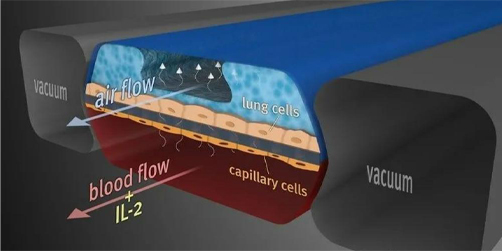
图片来源:知乎、万原点基金整理
1.2 发展历程
类器官的起源可以追溯到1907年,当时H. V. Wilson试图在体外再生生物体,并表明机械分离的海绵细胞可以重新组装和自组织成具有正常功能的新海绵生物体。1965年,在3D细胞培养的早期研究中,类器官被定义为异常的细胞生长或细胞内结构。1975年,莱茵瓦尔德和格林首次描述了长期培养人类细胞的方法。随着3D培养方法的发展,Emerman和Pitelka通过悬浮的胶原凝胶培养乳腺上皮细胞。1981年,首次从小鼠胚胎中分离出胚胎干细胞(ESC)。1998年,从的人类囊胚中分离出人ESC。
这些进步推动了干细胞生物学和类器官领域的进一步发展。2006年,通过引入四种转录因子将小鼠胚胎或成纤维细胞诱导PSC。2008年,Eiraku等人使用3D聚集培养系统从ESC产生基底极性的大脑皮层组织。2009年,Hans Clevers及Toshiro Sato等人证明Lgr5+的人肠道成体干细胞可以自组织和分化成隐窝-绒毛类器官。此后,类器官领域研究呈现出爆发式增长。目前,几乎所有的组织都可以在体外构建3D培养的类器官,包括人多能干细胞(hPSC)来源的肠道、视网膜、脑、肝、肾、胃、肺、胰腺、结肠、心脏、和血管类器官和人成体组织来源的胃、肝、胰腺、胎盘、和肺类器官。
不同类器官的建立时间轴
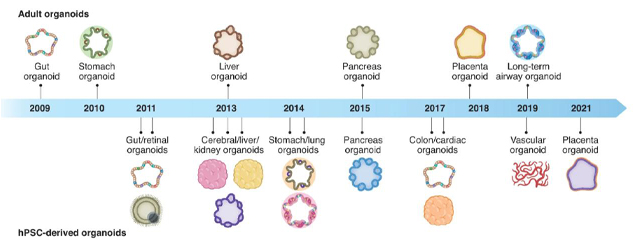
图片来源:奇物论、万原点基金整理
1.3 类器官培养
类器官可以从成体干细胞(ASCs)、多能干细胞(PSCs)(即胚胎干细胞,或ESCs),或诱导的PSCs(iPSCs)中衍生。类器官培养系统主要包括基质胶、维持类器官生态所需因子和分化所需因子等几个主要元素。基质胶中含有胶原、巢蛋白和纤连蛋白等等,为类器官形成三维空间结构提供基质。维持类器官生态因子主要目的为促进细胞的增殖和抑制细胞凋亡等。常用的基质胶为美国BD Biosciences公司的Matrigel®,在行业内处于较为垄断的地位,价格较高。Matrigel可以产生类似于哺乳动物细胞基底膜的生物活性基质材料,帮助多种类型的细胞达到附着和分化。
图片来源:CytoSmart、万原点基金整理
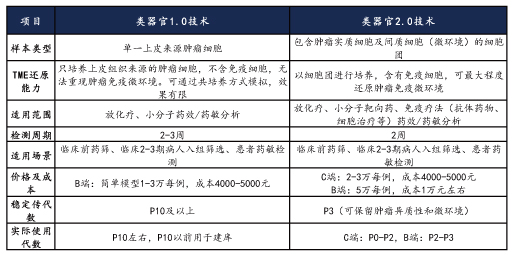
目前类器官的培养技术主要有两大类,一类是3D包埋法(类器官1.0),一类是气液交互法(类器官2.0)。
类器官2.0技术相比于1.0技术,以细胞团而非单细胞为起始进行培养,最大限度地保有了细胞组成和空间构成的原生状态。同时,2.0的培养模式能在为organoid提供充足养分的同时,满足组织微环境内各类细胞的充分供氧,更有利于器官组织的形成和生长。
下面以肿瘤类器官培养为例说明类器官1.0与2.0技术之间的主要区别:
类器官1.0培养技术的主要特点为:组织--酶解--上皮来源单细胞--仅肿瘤生长(胶内液面下培养)--培养完成后仅针对肿瘤本身分析
类器官2.0培养技术的主要特点为:组织--机械解离--肿瘤及微环境--原生肿瘤及微环境共同生长--培养完成后可针对肿瘤及整个微环境进行分析测试,还原了整个微环境
综上所述,类器官2.0相比1.0技术,可以更好的还原肿瘤微环境,可以进行免疫疗法的临床检测。同时,2.0技术检测周期更短,更符合临床患者用药方案筛选的实际需求。两者在培养成本上基本持平,2.0技术检测项目较多时,成本相对更高。
类器官1.0技术基于单一细胞,细胞组成更为简单,更易于培养传代,在对于上皮或上皮来源肿瘤的研究中具有一定优势。
类器官1.0与2.0技术主要特点对比
资料来源:万原点基金调研整理
1.4 类器官技术的主要应用
类器官技术作为一种新的人源化体外研究模型主要应用在科学研究、药物临床前开发和临床精准医疗领域,未来在药物临床病人入组、基因编辑、细胞疗法、器官再生等领域将有较大应用前景。
1.4.1 类器官技术在科研领域的应用
类器官在科研领域主要应用于疾病机理、药物筛选、转化医学、发育生物学、器官移植、蛋白组学和转录组学研究等。
以下是类器官技术在科研领域的应用案例:
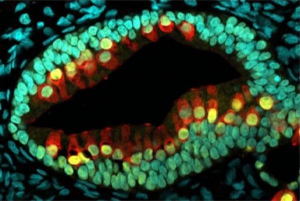
来自英国剑桥大学等研究机构的研究人员利用一种技术在实验室中培育出胆管类器官(bile duct organoids),并发现这种胆管类器官可用于修复受损的人类肝脏。相关研究结果发表在2021年2月19日的Science期刊上,论文标题为“Cholangiocyte organoids can repair bile ducts after transplantation in the human liver”。
该项研究为开发治疗肝脏疾病的细胞疗法奠定了基础,即在实验室中培育胆管类器官作为替代部件,用来恢复患者自身的肝脏健康或修复受损的供者肝脏,这样它们将仍然可以用于移植。
胆管作为肝脏的废物处理系统发挥作用,而胆管功能失常导致三分之一的成人和70%的儿童需要接受肝脏移植,没有其他治疗方法。目前肝脏供者短缺:根据英国国民保健服务(NHS)的数据,英国成人接受肝脏移植的平均等待时间为135天,儿童为73天,只有有限数量的患者能从这种治疗中获益,迫切需要增加器官供应或提供全器官移植的替代方法。基于细胞的疗法可能提供一种有利的替代方案。然而,在开始临床试验之前,这些新疗法的开发因缺乏在人体中的安全性和有效性适当模型的测试数据而受到阻碍和延迟。
在该项研究中,研究人员开发出一种新的方法,它利用最近的“灌注系统”将捐赠的器官在体外进行维持。利用这种技术,他们首次证实可以将实验室中培养的胆管细胞移植到受损的人类肝脏中进行修复。作为新方法的原则性证明,研究人员修复了由于胆管损伤而被认为不适合移植的肝脏。这种方法可能能够应用于多种器官和疾病,以加速细胞治疗的临床应用。
胆管类器官组织荧光染色图
图片来源:Journalist's Resource,万原点基金整理
1.4.2 类器官技术在药物早期发现的应用
药物发现是一项精细复杂的浩大工程,覆盖了从hit到lead,lead optimization、candidate selection及临床验证等一系列重要环节。位于源头的hit,既有根据靶点结构进行人工设计,也有通过高通量筛选(Highthroughput Screening,HTS)而获得。无论哪种方法,都需要工具来分析判断一个化合物是否有成药的潜力。这个工具就是各种各样的测试技术,包括使用各种实验模型。
老鼠等动物模型被广泛用于研究心脏病,提供有价值的结果。然而,由于许多功能和生物学特性的物种差异很大,它们对人类心脏疾病和药物安全性的推断很差。类器官具有高通量、高度组织还原性等特点,在早期药物靶标筛选的过程中将会发挥重要作用。
2019年6月澳大利亚昆士兰大学生物医学系的科学家在Cell Stem Cell发表文章,阐述他们基于96孔板,培养心脏心肌类器官,进而进行化合物筛选的新流程。基于类器官,将5000种化合物,筛选出不同功能化合物。
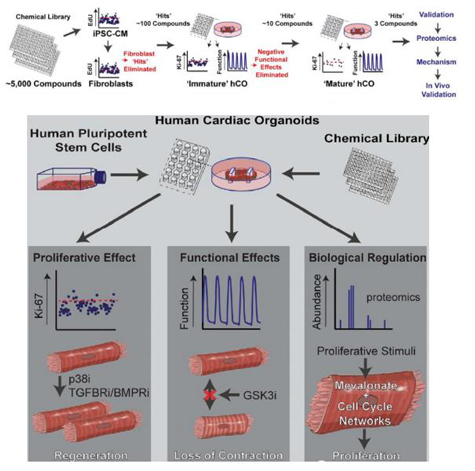
图片来源:Cell Stem Cell,2019,万原点基金整理
1.4.3 类器官技术在药物临床(前)开发的应用
长久以来,传统的疾病模型(细胞和动物模型)始终无法精确模拟出真正的人体系统,当前还没有能够很好模拟人体系统的疾病模型。根据FDA的调查数据,约92%在动物试验中证明了安全有效性的药物,却在临床试验中失败。
在临床前药企服务领域,类器官技术的应用场景主要聚焦于药理(PK/PD/ADME)、毒理检测,尤其在没有成熟动物模型而传统细胞培养体系又无法满足需求的场景中将发挥优势。
图片来源:澎湃新闻、万原点基金整理
眼药动学研究是眼科药物开发和指导眼科临床合理用药的关键。由于需要进行侵入性取样使得人眼药动学研究受到伦理限制,主要依赖于动物模型。但目前动物模型的局限性非常明显,不能将动物模型的眼药动学数据直接外推到人眼。比如人与动物玻璃体体积存在显著差异,人玻璃体体积为4mL,而猴、家兔、大鼠的玻璃体体积分别为1.9,1.5 mL和50~55μL。玻璃体中扩散路径长度的差异(家兔为9mm,而人类为22mm) 会影响药物的分布,且与人眼相比,兔眼后节药物清除半衰期缩短了1.7倍,眼前节药物清除半衰期缩短了2倍。
临床前眼药动学研究中可应用的动物模型较少,现有动物模型通常在给药后的不同时间点处死动物、取样和检测不同眼组织浓度,每次研究需要大量动物,非常麻烦且价格昂贵,还存在解剖方法不当而导致化合物重新分布的风险。一些替代模型仍处于早期研究阶段。系统了解眼药动学和替代模型的建立有助于将药物药理学特性、给药系统相关因素、眼球解剖学和生理学以及物种间因素整合在一起,从而促进眼科药物的开发和剂型改进等。同时,眼科药效学研究作为眼科药理学的重要组成部分,缺乏评价药效的相关动物模型,离体或体外替代模型则更少。眼睛类器官等新模型则有希望填补这一空白。
图片来源:公开信息,美迪西官网,万原点基金整理
将类器官技术应用于临床,指导临床用药和精准治疗是近期类器官技术的主要发展方向。事实上,自2016年起,类器官技术已被纳入临床试验中,截止到2020年9月,已有63起临床试验于FDA官方备案。中国国内2017年起注册且获伦理委员会批准的类器官临床试验研究有20项,涵盖8个癌种。主要关注化疗方法的疗效预测,但已有研究开始关注免疫疗法在类器官中的应用(长海医院,pd-1)。从癌种分布看,目前国内研究癌种多为消化系统肿瘤、胰腺肿瘤、乳腺肿瘤。
1.4.4 类器官技术在临床患者用药方案筛选的应用
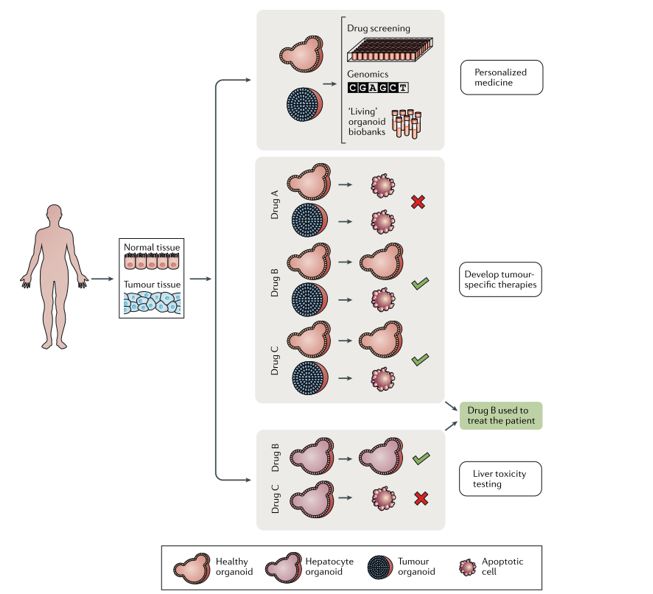
早期对症治疗可以为癌症患者带来更好的临床获益,以往医生评估所选药物的效果可能需要几个月的时间。在临床服务领域,类器官技术可更为真实的还原体内环境,比CDX/PDX等模型培养周期更短(2周出具报告)、通量更高,具有更高的准确性(2018年,《science》刊登的文章指出类器官在预测抗癌药物的有效性上,具有100%的敏感性、93%的特异性、88%的阳性预测值以及100%的阴性预测值,证明类器官能够有效的预测癌症患者的治疗反应),在肿瘤病人的用药方案筛选方面具有独特优势。
类器官可以从患者来源的健康组织和肿瘤组织中迅速培育,使患者特异性药物检测和个性化治疗方案的开发成为可能。在这种患者特异性的肿瘤类器官中,可观察到组织稳态(histostasis),可保留与来源患者肿瘤相一致的组织病理学特征。
在精准医疗领域,对于靶点及生物标志物的确认常采用NGS方法,二代测序从基因层面上检测出患者的靶点突变情况和潜在药物敏感靶点,为医生和患者提供初步用药选择,但单凭二代测序结果无法保证完全的临床疗效。基因分析的有效率在总体癌症中不到20%(像肝癌、胃癌、胰腺癌等大量的癌症并没有明显的治疗靶点),剩下的80%肿瘤可以用器官芯片实现精准治疗。类器官作为药敏验证的手段,可以在测序基础上进一步锁定有效药物,给出结论性建议以及实际证据。
NGS+类器官助力临床患者药物方案筛选
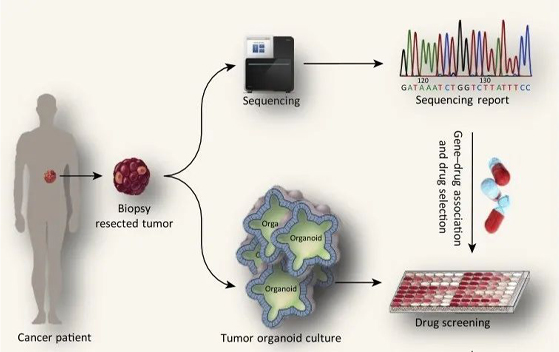
图片来源:Trends in Biotechnology,2018,万原点基金整理
1.5 类器官与传统模型的对比
研究模型作为技术工具广泛应用在药物早期发现、临床前研究、病人入组筛选、精准医疗等研究领域。相较于细胞系(cell lines)、CDX、PDX等传统研究模型,类器官模型不但能够取自正常组织和各个阶段的肿瘤组织,而且其培养体系简单易操作,时间和金钱成本较低,且具有较高效率,得到广大研究人员的青睐。
细胞系培养体系不具备免疫细胞、微环境、间质成分和器官特异性的功能。而且肿瘤细胞系经多次传代后缺乏来源肿瘤的遗传异质性,因为细胞在培养皿二维生长的环境下会发生优势克隆选择,不符合实际生理情况。这会导致在用二维肿瘤模型进行检测时,很低浓度的药物就可以把大量的肿瘤杀死,但在动物体、三维模型上或真实的环境中,肿瘤的耐药性会显著提高。
人源肿瘤细胞系异种移植(cell derived xenograft, CDX),即将体外传代培养的肿瘤细胞接种至免疫缺陷小鼠。CDX的优势在于细胞系易于获得,建模成本低等。但人源肿瘤细胞系经长期体外培养后,其肿瘤细胞生物学行为及基因谱表达水平、 肿瘤异质性都与原始肿瘤组织存在较大的差异,从而在预测临床药效方面不甚理想。有研究表明,经此模型鉴定筛选的药物仅约1/3在二期临床试验中验证有效。
人源肿瘤组织来源移植瘤模型 (patientl derived xenograft ,PDX),通过将病人新鲜的瘤组织直接移植到免疫缺陷小鼠体内而建立的肿瘤模型。PDX可稳定地保留肿瘤的遗传特性、组织学和表型特征,即肿瘤异质性。PDX可用于筛选化疗药物敏感或耐药标记物,其试验结果具有较好的临床预见性。PDX在移植过程中较好地保留了肿瘤间质和干细胞成分,使得肿瘤的生长微环境更接近实际情况。
但PDX仍然存在明显的局限。目前PDX模型原始肿瘤的主要来源为手术切除,建模难度高且不能反复获取,构建时间长且成功率不稳定,随着传代次数增加肿瘤微环境也会逐渐被小鼠细胞外基质取代,因此对于传代次数有一定限制。另外,负荷肿瘤的小鼠均为免疫缺陷的小鼠,因此PDX无法用于筛选免疫相关药物。研究人员在尝试开发能模拟完整的人类免疫系统的小鼠模型,但目前还没有达到理想的效果。
类器官与传统模型主要指标对比
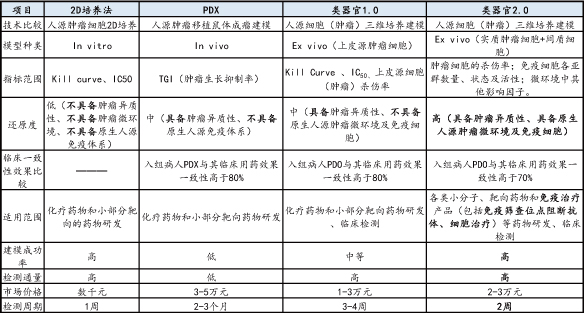
资料来源:昊佰生物、万原点基金调研整理(注:市场价格一栏以药敏检测为例)
1.6 PDX市场规模及国内主要PDX厂家
1.6.1 PDX市场规模
根据Research and Markets数据,全球PDX模型市场规模预计将从2021年的1.4亿美元达到2026年的2.99亿美元,预测期内复合增长率为16.4%。市场增长主要受个性化药物需求增长、癌症研究持续支持、医药研发增长等因素驱动。另一方面,个性化PDX模型的高成本、癌症研究中严格的动物伦理使用指引以及PDX模型相关的局限性预计将在预测期内在一定程度上抑制市场的增长。
PDX模型主要应用于临床前抗肿瘤药物开发、靶标分析和基础癌症研究,其中临床前抗肿瘤药物开发业务的增速最快,该分部的高增长归因于每年临床试验数量的增加。类器官技术在应用端与其有一定交叉,由于类器官技术具有更高的人体还原性、培养周期明显更短、成本更低,因此随着类器官技术数据的不断积累,有望逐步替代PDX模型,而且类器官技术可以用于肿瘤以外其他疾病和正常组织中毒理的研究和检测。
1.6.2国内主要PDX厂家产品
国内主要PDX厂家产品对比表
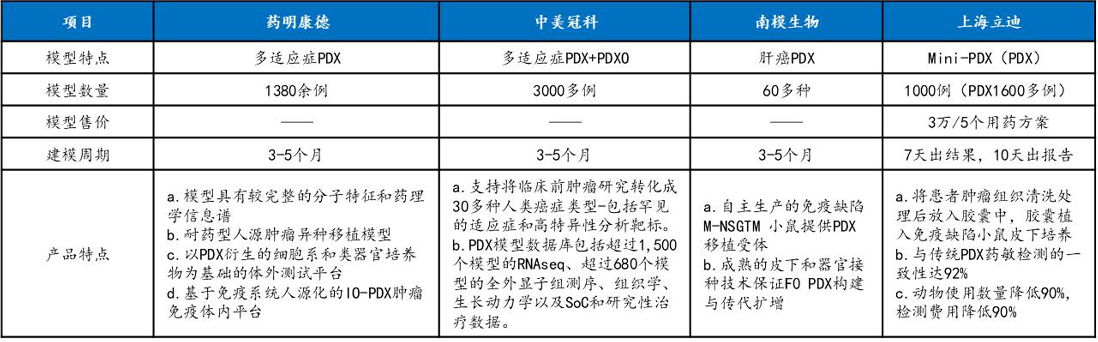
数据来源:公开信息、万原点基金调研整理
国内主要的PDX模型供应商有药明康德、中美冠科、南模生物、上海立迪、集萃药康和美迪西等,中美冠科成功开发的PDX模型数量最多,达到3000例以上,并具有丰富的模型数据库。中美冠科在PDO领域也有一定建树,公司通过与荷兰HUB授权合作,基于其大量的PDX模型库,开发了稳健且可重现的PDXO模型,以PDX(体内)+PDXO(体外)的模式助力新药研发。药明康德基于其在临床前和临床研发外包领域积累的雄厚实力和资源,具有较强的PDX产品服务实力,并可提供一定的类器官培养服务。南模生物和集萃药康为模式生物头部企业,依托自身动物模型的研发、繁育和分析检测优势,在PDX领域占有一定的市场份额。上海立迪主要从事人源肿瘤动物模型的建立及相关药物筛选服务,早期以提供PDX模型为主,2018年公司发布新产品miniPDX,为国内外首创,miniPDX在培养周期、成本和临床一致性方面显示出较大优势,但业内人士表示其与PDX能够提供的检测指标有较大差距,应用领域较为有限。
2 类器官产业与市场
2.1 类器官产业链
类器官培养作为一种3D体外细胞培养技术,需要用到细胞培养用到的基本设备、耗材,常用的设备硬件有显微镜、培养箱、操作台、移液枪等,耗材有基质胶、培养基、培养皿、超低吸附板等。
类器官技术企业主要依托类器官培养技术和构建的类器官系统(设备、软件)为药企、医院和科研用户提供类器官水平的检测服务或相关产品。由此,类器官已形成了较为完整的产业链,从上游原材料的提供商,到中游的类器官技术供应商,以及下游的药企、CRO、医院、科研机构等终端用户。类器官产业链如下图所示。
类器官产业链示意图
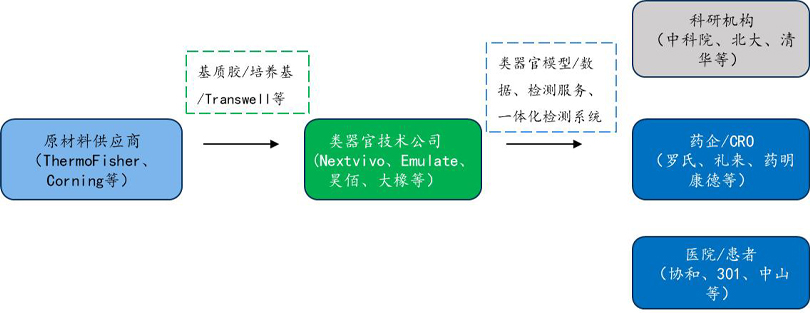
资料来源:公开信息、万原点基金整理
类器官产业链上游,以提供类器官培养耗材(包括培养基、细胞生长因子、冻存液、消化液、基质胶、超低吸附板等)、培养设备和检测设备的企业为主。其中包括ThermoFisher、Corning、R&D等代表性企业。
产业链中游,以提供人或者动物类器官培养、检测服务、冻存建库以及类器官传代等服务的类器官技术公司,代表性企业有Nextvivo、Emulate、上海昊佰、大橡科技等。
产业链下游主要为运用类器官技术进行药物早期靶点筛选、临床前药物开发和患者用药方案筛选的科研机构、药企、CRO和医院。
类器官的科研应用目前主要集中在疾病模型研究、疗效预测等方向。目前多所高校和医院已经开展了相应的科学研究,如中科院、清华、浙大、北京天坛医院、浙大附一等。PDO技术路线比起传统路线的优势与潜能已获得学界认可,PUBMED发布的含Organoid的学术论文于2019年已经超越PDX模型论文年发表数量,中国国内2017年注册且或伦理委员会批准的类器官相关临床试验研究达到20项。
未来类器官科研市场将来相对增长放缓,类器官服务方将以销售试剂耗材为主。随着科研市场进一步发展,科研院校将搭建并优化自己的平台做培养和检测,但科研市场高度定制化需求难以提供标准化服务。
临床研究应用目前主要为癌症中晚期患者提供精准治疗。病人直接试药耗时长、风险大且过程痛苦,特别是缺乏有效药物只能通过化疗的肿瘤患者,难以及时找到有效解决方案。而类器官可代替病人试药,实现精准治疗。目前类器官以化疗药、靶向药的敏感性检测为主,未来在免疫疗法的筛选上具有更大的潜力。
目前包括南方医院、长海医院、华西医院、复旦大学附属肿瘤医院等医院已经开展了相应的临床研究。目前类器官的临床市场仍在培育阶段:由于未写入指南,患者的认知度以及临床医生的送检意愿有限,随着PDO在临床应用的增加,预计在精准治疗趋势下, PDO在临床市场的需求将大幅度增长。类器官对于患者,尤其是对于缺乏有效药物或者生物靶标不明确的肿瘤患者,有极大价值,其可以作为实现精准治疗的有效工具。
类器官在商业市场的应用主要在新药研发以及拓展适应症等方向。类器官更为接近人体的真实环境,可在临床前进行更充分的效价评估,对于后期药物开发成本的降低有巨大的价值;在抗肿瘤药物研发中,PDO能够高通量低成本地反应肿瘤异质性,有效弥补PDX动物模型的不足,可提高临床试验成功率。包括罗氏、礼来、先声药业、齐鲁药业以及药明康德等药企/CRO已经开始运用类器官技术进行临床前的药物开发。
目前类器官药物研发市场仍在初始阶段,由于类器官技术并未纳入FDA或CDE的新药审评体系,药企仍在观望阶段,且类器官技术成熟度和样本库存量仍有限,类器官公司的目前收入主要为药效验证服务。目前有愿意尝试和付费能力的主要为以MNC为代表的大型药企或创新型的Biotech。国家药监局2021年11月19日正式发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》,提高了药物研发的门槛,药企对于新药研发降本增效、提高成功率的需求剧增,将进一步推动类器官在药物开发阶段的应用。
类器官技术企业是否建立起严格的质量控制和标准化体系,是否具备商业化可复制、稳定性强的泛癌种培养能力是大规模产业化的关键要素。
2.2 类器官市场规模
类器官作为一种较为前沿的培养技术和研究模型,在靶点早期发现、药物临床前开发、精准医疗等领域具有较大应用潜力。类器官行业目前的商业模式与CRO、PDX比较接近,随着国内外创新药研发投入的不断增加、精准医疗在临床端的推进和国家政策的鼓励,类器官市场有望稳步提升。
2.2.1 全球药物研发市场稳步增长,我国药物研发投入增速较快
全球药物研发市场呈现稳健增长的态势,中国医药市场近年来发展较快,占全球药物市场规模的比例稳定上升。
2019年,全球医药研发投入规模达到1,824亿美元,其中药物发现阶段、临床前阶段、临床阶段的研发投入为381亿美元、206亿美元和1,236亿美元。2015年到2019年的CAGR为5.0%,随着发展创新药成为大势所趋,药物研发投入将继续攀升,全球医药研发支出预计在2024年将会达到2,270亿美元,2019年至2024年CAGR达到4.5%。
国内医药研发行业起步较晚,研发投入规模相比国外较小,但随着国内创新药市场需求的提升、政策支持力度的加大、药企研发实力的增强,国内医药研发支出呈现较快增长态势,由2015年的105亿美元增至2019年的211亿美元,CAGR为19.1%;预期到 2024年将达476亿美元,2019年至2024年的CAGR高达17.7%,国内医药研发投入规模具有广阔的增长空间。
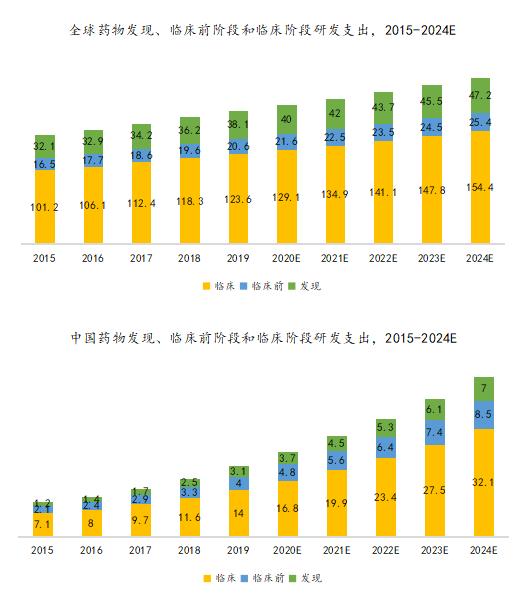
资料来源:泰格医药H股招股书、万原点基金整理
2.2.2 全球CRO市场保持较快增长,我国CRO市场增速明显快于全球
全球CRO市场规模保持较快增长态势。2015-2019年,全球CRO市场规模由443亿美元增至626亿美元,CAGR达到9.0%。预计到2024年,CRO市场规模将达到960亿美元,2019至2024年CAGR达到8.9%。
国内CRO市场规模保持高速增长态势。2015-2019年,国内CRO市场规模由26亿美元增至68亿美元,CAGR高达27.3%;预计到2024年,我国CRO市场规模将达到222亿美元,2019-2024年的CAGR将达到26.5%。
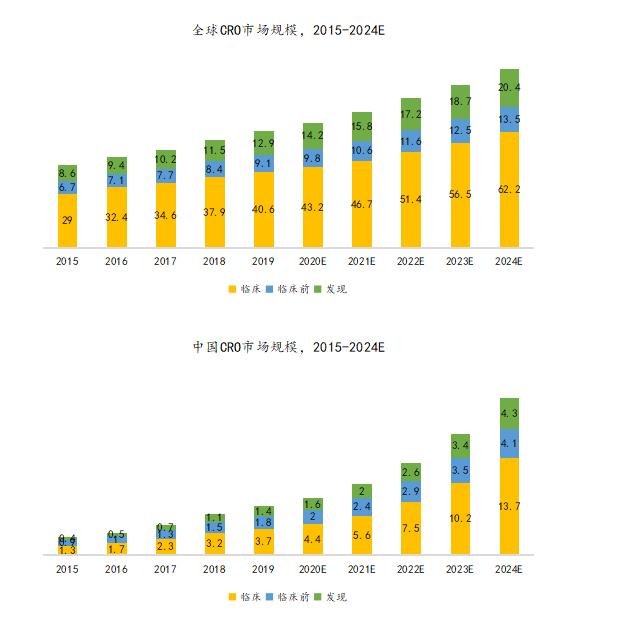
资料来源:泰格医药H股招股书、万原点基金整理
2.2.3 我国动物模型市场近年来蓬勃发展,类器官技术将成为重要补充
根据Frost & Sullivan统计,全球动物模型市场(不含动物模型相关服务)从2015年的108亿美元增长至2019年的146亿美元,复合年增长率为7.8%。
中国动物模型市场相对处于发展早期。啮齿类实验动物作为实验动物模型中最重要的一大类,其国内产品和相关服务市场规模呈高速增长态势,从2015年的10亿元人民币增长至2019年的33亿元人民币,复合年增长率34.7%。随着生命科学研究和新药开发的蓬勃发展,预计到2024年,国内啮齿类实验动物产品和服务的总市场规模将增长至98亿元人民币,复合年增长率约为24.2%;预计至2030年,其市场总规模预计将达到272亿元人民币,复合年增长率约为18.5%。

资料来源:Frost & Sullivan、万原点基金整理
2.2.4 类器官市场规模与估算
相关报道称,2019年北美类器官市场达到2.9139亿美元,预计将在2027年达到14.0647亿美元,将以21.7%的复合年增长率增长。根据世界卫生组织发布的最新数据,2018年,全球新发癌症1810万例,而中国新发癌症429万,占比全球23.7%。预计2040年,全球新发癌症病例高达2950万例。随着新的药物管线的不断涌现,临床和患者对个体化治疗的需求日益增进,类器官市场空间将持续增长。
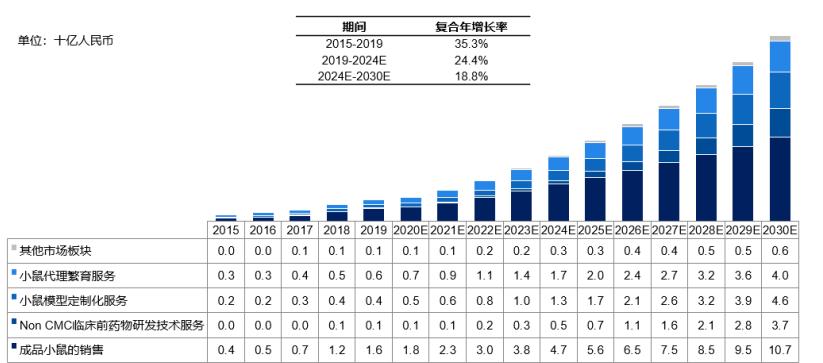
中国实验小鼠产品及服务市场,2015-2030E
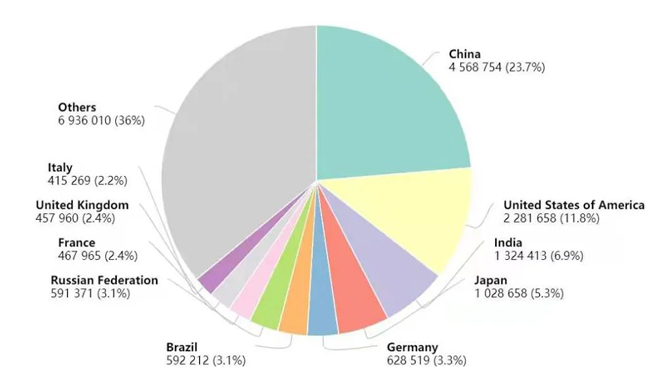
2020年世界各国癌症新发病例数
 数据来源:医药魔方、IARC
数据来源:医药魔方、IARC
目前类器官技术的主要应用场景在于药企临床前研发端的药理毒理检测和医院患者药物筛选,类器官技术公司分别以CRO和临床检测的方式分别提供相应服务。
根据Frost & Sullivan数据,中国实验小鼠产品和服务市场呈高速增长态势,2019年市场规模为28亿元,预计到2024年市场规模将达到84亿元人民币,复合年增长率约为24.4%;到2030年,国内实验小鼠产品和服务的整体市场规模将达到236亿元人民币。我国2019年临床前药物研发支出约为276亿元人民币,实验小鼠产品和服务的市场规模占比临床前研发支出比例约为10.14%。类器官作为新的研究模型,我们以1%的临床前研发支出比例进行估算,对应药企临床前研发的检测市场规模约为2.76亿元。
对于医院患者药物筛选的市场,我们以2020年肿瘤类疾病新发病患者数量为基础,以1%的渗透率、每例患者进行药物筛查按照2万元收费估算。据世界卫生组织国际癌症研究机构(IARC)发布的2020年全球最新癌症负担数据显示,2020年中国新发癌症病例457万例,癌症死亡病例300万例。估算得到目前我国类器官临床患者药物筛选服务的市场规模约为9.14亿元。
综上所述,我国类器官技术市场潜在规模现阶段总计约为11.90亿元。
2.3 国内外类器官技术代表性企业
类器官的领头人Hans Clevers成立的HubrechtOrganoid Technology(HUB)是类器官最早的研发中心,HUB技术授权促进了第一批类器官公司的涌现。目前类器官公司多为政府、学术界和产业界三方联动的助推模式。产品销售和服务的混合商业模式。类器官应用于药筛的头部公司,需要具备泛癌种培养能力以及达到商业转化水平的稳定性的水平,有严格的质量控制和标准化体系,且在培养涉及的仪器和鉴定筛选平台方面需要往自动化方向靠拢。
中国在类器官领域中,近年来呈现出科研数量大幅度上升的趋势,尤其在2019-2020年这两年间显现出了强劲的发展势头,发表的文献数量在全球的排名从第六位(2009-2019年)跃至第二位(2020年),仅次于美国。
2.3.1 国外类器官代表性企业
Xilis:
Xilis成立于2019年,由杜克大学(Duke University)的Xiling Shen博士,David Hsu博士,与Hans Clevers博士创立。Hans Clevers博士是类器官技术先驱之一,曾获得有“科学界奥斯卡”之称的科学突破奖(Breakthrough Prize)。
利用MOS和Xilis的AI成像分析工具,该公司正在开发一种精准肿瘤学平台,可以快速准确预测治疗反应,帮助临床医生及时制定有针对性的个体化癌症治疗策略。从患者活检取样到获得结果的整个过程只需要不到两周时间,能够大大减少患者的无效治疗周期,有助于降低癌症治疗成本负担。
主要技术路线:3D包埋法(organoid1.0)
NextVivo
NextVivo 是一家开发免疫类器官技术平台的生物技术公司,2021年12月公司宣布完成790万美元的首轮融资,由Khosla Venture领投,Alexandria Venture Investments、Wilson Sonsini 和个人投资者参与。 NextVivo联合创始人Mark Davis、Calvin Kuo 和 Adam Margolin计划开发第一个能够在具有免疫能力的人源模型中生成和测试疗法的类器官平台。2021年底完成天使轮融资,还未开展临床一致性研究。
NextVivo 类器官是微型 3D 组织模型,可以独特地保留人体器官的所有关键细胞类型,包括免疫细胞。随后对各种健康和疾病组织类型的器官和免疫细胞之间的功能相互作用进行概括,可以通过利用免疫系统的自然防御来产生候选疗法。
主要技术路线:ALI气液交互法(organoid2.0)
2.3.2 国内类器官代表性企业
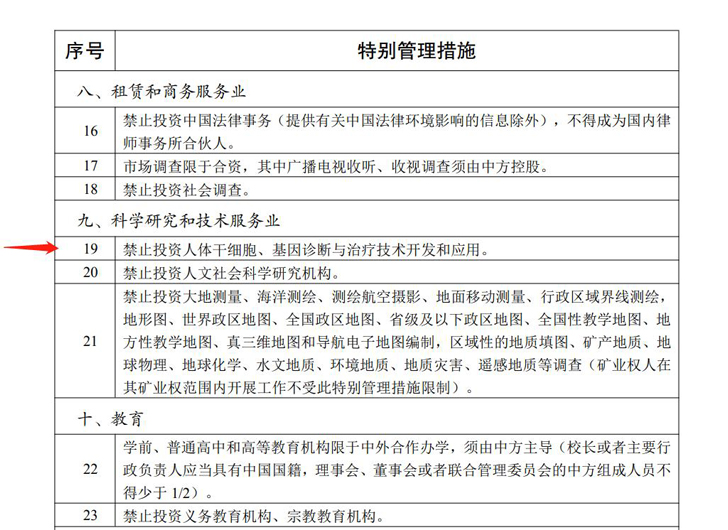
2021年12月27日,国家发展和改革委员会和商务部共同发布了第47号、第48号令,该令经党中央、国务院同意,由国家发展和改革委员会主任何立峰、商务部部长王文涛署名发布:“《外商投资准入特别管理措施(负面清单)(2021年版)》、《自由贸易试验区外商投资准入特别管理措施(负面清单)(2021年版)》自2022年1月1日起施行。
负面清单中列示禁止外商投资“人体干细胞、基因诊断与治疗技术开发和应用”,“医疗机构限于合资”。类器官技术涉及到人体干细胞的使用,所以国内类器官市场将主要由国内企业参与竞争,对国内类器官市场属于政策面利好。
外商投资准入特别管理措施(负面清单-部分)(2021 年版)
昊佰生物
上海昊佰生物科技有限公司(简称昊佰生物)创立于2019年8月,紧靠上海新虹桥国际医学中心,是国内唯一采用类器官1.0(3D包埋式培养法法) 和类器官2.0(Air-Liquid-Interface,气液交互式培养法)双技术平台进行类器官培养、实现多维度服务的“国家高新技术企业”。由昊佰生物旗下上海易对医生物医药科技有限公司(以下简称易对医)独立承办的《上海市类器官建模与应用专业技术服务平台》已获得上海市科委的验收通过。
昊佰生物核心研发团队由来自美国斯坦福大学的顶尖科学家组建而成,拥有多项知识产权(含发明、实用新型、著作权等专利),建立了依托于类器官培养法的药敏评估体系和一整套自取样、培养、冻存、传代、建模、药敏测试、流式检测、检验报告等企业标准,致力于打造规范的药物敏感性评估体系和前沿的新药评估筛选平台,同时兼顾基础研发与临床转化以及类器官在精准医疗与再生医学的应用。
昊佰生物运用与众多三甲医院的良好合作关系,成功建立了包括肠、肺、胃、肝、骨肉瘤等组织来源的整合式类器官,在体外重现其原生微环境复杂组成和功能。目前已培养出1300余例类器官(包括胃、肠、肝、肺、胰腺、胆管、头颈等)并成功建模(其中肝肿瘤和骨肉瘤的TME建模属世界首创),可供学术研究和临床转化的CRO服务。
主要技术路线:ALI气液交互法(organoid2.0)、3D包埋法(organoid1.0)
公司技术优势:目前国内唯一一家拥有类器官2.0技术的公司,类器官2.0(Air-Liquid-Interface,气液交互式培养法)技术在肿瘤免疫药物用药指导上面具有快速准确的优势。昊佰生物领先全球率先开发出类器官免疫药物检测体系,并在肝癌、胃癌的临床一致性研究中初步取得了72.73%和66.67%的准确性,为后续临床检测用药指导、药企新药研发、临床实验患者入组筛选等服务提供有力数据支撑。
上海丹望
丹望医疗科技上海有限公司位于上海南翔精准医学产业园,致力于将最新的再生医学类器官技术临床转化,应用于疾病的诊疗、新药筛选、肿瘤标志物开发与鉴定,努力为临床提供个性化治疗的新技术,为新药研发提供精准、高效、优质的类器官模型。公司拥有全球领先的类器官技术创新平台,已建立了肺、胰腺、乳腺、胃、肠、肝等多个人体器官组织的类器官培养体系。公司拥有类器官领域的专业团队,创始人华国强博士深耕类器官技术多年,具有丰富的疾病模型建立和药物研发临床前开发经验;技术团队由多名类器官领域的国际化人才组成,其中国际类器官领域的鼻祖Hans Clevers院士以联合创始人和首席顾问科学家身份加盟丹望医疗。公司于2021年10月成功完成1.2亿人民币A轮融资。
主要技术路线:3D包埋法(organoid1.0)
北京科途
北京科途医学科技有限公司成立于2016年8月,由前百济神州高级研究员孙志坚博士、前百普赛斯生物(ACROBiosystems)联合创始人康平先生、中科院营养所教授/首席科学家谢东教授共同创立。科途医学是国内最早专注于类器官技术研发与商业转化的公司,团队核心成员曾服务于诺华制药、百济神州、GE医疗、中国科学院、301医院等知名药企、医院及科学研究和CRO服务机构。
科途医学在北京经济技术开发区汇龙森科技园已建设了800㎡的研发中心,在中科院湖州科创中心建设了1300㎡的临床医学检验所及GMP级细胞培养生产车间。目前已建立了类器官抗癌新药研发与精准医疗协同创新平台、临床医学检验平台、GMP级细胞培养平台、药理学药效学研究评价平台及现代化细胞储存库等完善的平台框架。
科途医学目前已与国内三十余家三甲综合医院和肿瘤医院临床科室展开了临床研究与转化合作,为国内外多家药企提供抗癌新药研发技术服务,与国内创新药物研发企业建立战略合作,并与多家国际知名研究机构建立了科研合作。
主要技术路线:3D包埋法(organoid1.0)
广州创芯
创芯国际生物科技(广州)有限公司是一家以类器官技术为核心的创新型生物医疗企业。 公司于2016年成立于澳门,总部位于广州开发区加速器。目前分别在北京、上海、广州和意大利米兰设立研发中心,拥有2家控股子公司,业务覆盖全国22个省区。创芯国际提供科研与临床精准治疗的肿瘤类器官药物敏感性检测平台、行业上中下游产品的转化与生产、新药研发-体外CRO服务,致力于个体化治疗、新药研发及再生医学三个方向,拥有完整的类器官全产业链。
主要技术路线:3D包埋法(organoid1.0)
大橡科技
北京大橡科技有限公司成立于2018 年11月13日,是全球领先的研发和生产人体类器官芯片的前沿科技公司。自成立以来,公司发展迅速,已成为中国类器官芯片领域的标杆企业。
主要技术路线:类器官芯片+类器官1.0(3D包埋法)
骆华生物
安徽骆华生物科技有限公司于2019年5月由中国科学技术大学骆天治教授及其科研团队在合肥市高新区发起成立。公司致力于器官芯片技术开发,为科学研究、再生医学、细胞工程、个性化治疗方案、药物研发及医疗技术研发等领域提供具备国际先进水平的产品和技术服务。
主要技术路线:器官芯片+类器官1.0
3 类器官产业的未来发展
3.1 类器官领域相关国家政策
2021年1月28日,科技部下发的《关于对“十四五”国家重点研发计划6个重点专项2021年度项目申报指南征求意见的通知》中,把“基于类器官的恶性肿瘤疾病模型”列为“十四五”国家重点研发计划中首批启动重点专项任务。另外,“十四五”国家重点研发计划中重点指出,类器官作为一项重大的技术突破被用于疾病模型的建立中,且可用于研究病理状态下干细胞变异、异质性及其发生机理,挖掘疾病诊疗的新靶标,探索诊疗新策略。类器官技术在未来将有非常大的应用价值和发展前景。
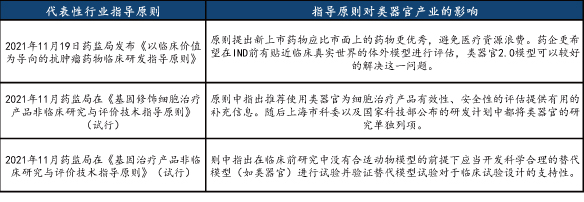
2021年11月19日药监局正式发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》原则,提出“新药研发应以为患者提供更优(更有效、更安全或更便利等)的治疗选择作为更高目标”,明确指出了“'对照药’是体现新药临床价值的基础”,“应该关注阳性对照药是否反映和代表了临床实践中目标患者的最佳治疗选择”,政策表明了监管层对于国内创新药研发的态度,并在一定程度上提升了创新药的研发门槛。新药研发企业为提高新药研发的成功率势必会加强在临床前和临床各阶段的数据质量和更优的试验设计方案,对于更接近人体真实环境的类器官模型的应用将起到推动作用。
2021年11月30日,国家药监局药审中心发布《基因治疗产品非临床研究与评价技术指导原则(试行)》和《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》,首次将类器官列入基因治疗及针对基因修饰细胞治疗产品的指导原则当中。
类器官领域主要国家政策和指导原则
资料来源:公开信息、万原点基金整理
3.2 类器官产业的发展趋势
低成本。类器官作为新一代研究模型,成本虽然比PDX更低,但远高于细胞系。传统类器官培养需要使用基质胶(如Matrigel、Collagen)、培养基、Transwell或超低吸附培养板(24/96/384孔)等耗材,主要耗材成本较高,如康宁公司的Matrigel ,5ml价格约为200美元。Matrigel的来源是小鼠肉瘤细胞系,批次间存在一定变异性。另外,基质胶类的核心原材料目前主要依赖进口(Corning、R&D)。因此,批间一致性高的基质胶研发以及核心耗材的进口替代是行业未来发展的关键因素之一。
血管化。目前大多类器官本身并不具备血管化结构。因此,随着类器官体积的增长,类器官受限于氧气的缺失以及代谢废物的增加,可能导致的组织坏死。已有研究构建血管内皮细胞微环境的肿瘤类器官,将类器官肿瘤细胞和血管内皮细胞在Matrigel上共同培养,生成血管结构以期解决类器官血管化缺失的问题。
免疫化。血管化以外的难点还包括模拟肿瘤和免疫环境的相互作用关系。2019年Nature Protocol发表了肿瘤类器官和免疫细胞共同培养的相关protocol,可以体现和模拟出肿瘤微环境的部分特征。以上皮类器官和免疫细胞共培养模型为例,可通过在培养基中添加活化的免疫细胞、在组织消化成单细胞后和免疫细胞共同生长、添加ECM中的重组细胞因子等方法重塑类器官和免疫细胞的相互作用。
系统化。相比于单个类器官,类器官系统的构建能够对药物疗效和潜在毒性做出更完整全面的评估。目前类器官仅能检测出药物对于肿瘤的抑制效果,对于其他器官组织是否存在其他副作用和安全性风险并不能做出预判。为了解决这一问题,2017年Skardal et al.构建了有心脏、肺部、肝脏组成的集成于闭合循环关注体中的类器官系统,以达到全面揭示药物对不同器官的毒性和药效的目的。
标准化和自动化。类器官的培养是从取样、培养、检测到出具数据报告的一套完整的体系,目前主要环节中还主要以人工参与为主,每一个中间环节的操作、质控都将会影响最终检测结果。因此类器官全面产业化的前提,一个是行业政策层面的鼓励支持,一方面是产业自身的标准化和自动化推进。
从标准化的第一步取样来说,肿瘤组织取样的部分非常关键,初始的样本量及细胞质量直接决定了类器官培养的成功率。样本需要高活性和干性的细胞,对于肿瘤组织来说,最好是来源于干细胞。外层细胞处于分化终末期,干性较差;内层细胞常常处于缺氧坏死状态,活性较差。
以胰腺癌为例,只有小于20%的患者能够通过根治性手术切除获得肿瘤切除样本。余下高达80%的患者发现即为中晚期,无法通过手术获得足量的组织样本,类器官样本常常通过超声内镜引导下的细针穿刺活检(EUS-FNA)获取。EUS-FNA穿刺获得的样本量较手术中穿刺的更少,同时还与临床操作医生的经验相关。如果穿刺样本量很少、活细胞数量较少、或者没有穿刺到阳性的细胞群,类器官的构建都会面临较大挑战。对于在肿瘤的什么病灶取什么样本、样本需要满足什么样的条件等需要建立严格的标准以保证后续类器官培养的成功。
在类器官的培养过程中需要将组织放在基质胶中,物理参数和生长因子可及性的局部差异可能带来类器官在形状、大小和分布等方面的差异性,而临床上药筛类器官的应用需要达到较高的均一性,因此从类器官的取样、样本前处理、培养、检测等关键环节的自动化和AI化将是行业重要的发展趋势。
血管化、免疫共培养、系统化及自动化的实现可以进一步提高类器官应用的准确性和便利性,但考虑到检测周期、成本等关键应用因素,目前尚无法全部兼顾,如果这些趋势未来在周期成本可控的前提下可以全部实现,届时类器官将会在药物开发和精准医疗领域释放更大潜力。
随着微流控、AI等技术与类器官的融合,以器官芯片为代表的新产品形态将会具有显著优势,首先器官芯片微米级的尺寸对于样本的需求量更小,基质胶、培养基等用量少,更容易实现精细化和产品标准化,并且可以实现更高仿生度的模型的建立等,在成本端和准确性方面有望实现大幅提升。
3.3 器官芯片和相关应用
3.3.1 器官芯片概述
器官芯片是近年来快速发展的一项新兴前沿交叉科学技术,有望增加新药研发的成功率、缩短周期、节约成本,并有望促进基础研究成果的临床转化。2016年,该技术被达沃斯世界经济论坛列为 “十大新兴技术” 之一,2015年Nature称器官芯片是未来可能替代动物试验的革命性技术。
人体器官芯片技术是指在芯片上构建器官生理微系统,通常以微流控芯片为核心,将生物学、材料学以及工程学知识相结合,在体外模拟包含活体细胞、生物流体、机械力刺激等要素的组织器官微环境。该技术在生命科学研究、疾病模拟、新药研发、个性化医疗等领域具有广泛应用前景。
2010年Ingber教授在Science刊文,提出了世界上首个人肺器官芯片模型,开启器官芯片研发的浪潮。2011年,美国NIH,FDA和国防部牵头推出 “微生理系统” 计划 (microphysiological system,MPS计划),把器官芯片技术的开发和应用上升到国家战略层面,随后欧洲国家也相继加大对器官芯片的投入。
器官芯片包括单器官芯片和多器官芯片两大类,前者包括肺芯片、心脏芯片、肝脏芯片以及肠芯片等。后者是把多种不同器官和组织的细胞培养在芯片上,然后通过微通道连接起来,集成一个相互作用的系统,以模拟整个系统中器官和组织的不同功能。即实现 “human-on-a-chip”,是器官芯片发展技术的重要趋势。
器官芯片示意图

多器官芯片示意图
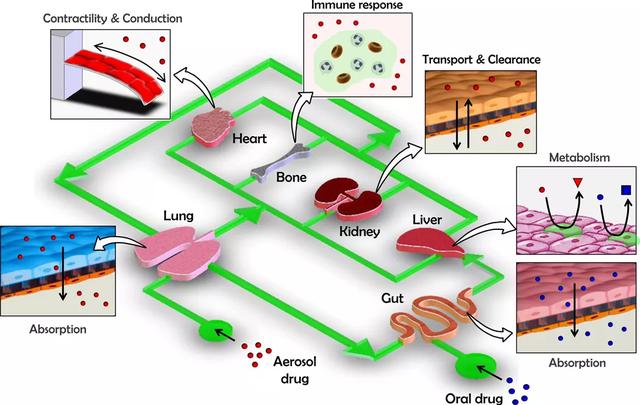
图片来源:japaneseclass、Donald E.Ingber 研究论文、万原点基金整理
2020年3月,Wyss研究院发文将包括肺、肠、心脏、肾脏、肝脏等10个器官芯片完整集合至Interrogator系统,且该系统在3周内维持功能。
与单器官器官芯片相比,多器官芯片更能够反映出人体器官功能的复杂性、功能变化、相互作用关系、完整性等。多器官芯片在新药研发以及研究中更具有应用价值,意义更大。多器官芯片除了能够观察到某种药物对不同器官的作用,还可以观察到这类药物对于不同器官产生的副作用,以及对整个系统的影响和治疗效果。
2019年9月,美国环境保护署(EPA)宣布将在2035年前最大限度地减少进行或资助哺乳动物研究,并推行替代方法。在发展蓝图中,他们提出的两种解决方法分别是计算模拟和器官芯片。与此同时,FDA也在推行器官芯片体外模拟试验,试行利用器官芯片积累的 PD/PK数据进行新药申报工作。
3.3.2器官芯片市场规模
根据市场研究公司Research Dive数据,到2028年,预计全球器官芯片市场规模将从2021年的5464万美元增长至近7亿美元,年复合增长率约为37.6%。其中,在药物筛选场景下的器官芯片发展势头更具有前景。公开资料显示,包括罗氏、阿斯利康、诺华、辉瑞等在内的制药大厂基本都已经在利用器官芯片模拟体外试验。国内恒瑞医药、先声药业等公司也在应用器官芯片进行新药研发。
整个器官芯片的产业化应用还处于早期阶段,整个器官芯片的产业化应用还处于早期阶段,现在采用的器官芯片复杂程度各异,仿真度也有待优化,行业还需要不断进阶。未来将会在仿真度(高复杂度仿真度)、自动化(芯片自动化培养、仪器自动化、自动化分析检测)和实时动态检测(连续原位、非侵入多生物标记物检测)和行业标准化(从厂家标准到行业标准)等方面进行不断迭代和提升。
3.3.3器官芯片代表性企业
Emulate是器官芯片领域的领跑者,2013年从哈佛大学Wyss研究所分拆独立运营。2021年7月,该公司获8200万美元E轮融资,总融资金额约为2.25亿美元。Emulate从 Wyss 研究所获得技术授权,其团队现已经推出了肺、肠、肝、肾的芯片,以及皮肤、眼睛、和血脑屏障系统该,并与阿斯利康、强生和科文斯等公司达成合作。
在国内,2017年和2018年科技部连续设立了两个和器官芯片相关的国家重点研发计划,分别是由上海中医药大学牵头的“基于器官芯片技术的中药安全性有效性评价体系”,以及由东南大学牵头的“人体器官芯片的精准介观测量”。国内器官芯片领域的公司包括北京大橡科技和苏州艾玮得生物等。
Emulate公司Organ-on-a-Chip产品
图片来源:Emulate公司官网,万原点基金整理
3.3.4 器官芯片的发展趋势
器官芯片在产业化应用不断提高的同时,距离真正实现更广泛的应用还有多个问题需要优化和解决。
首先是提高仿真度,即怎样更加的精准模拟人体器官,这是器官芯片最本质的问题。目前,市场上大部分芯片还是处于第一代和第二代芯片,以微流体结合的简单细胞培养为主,整体还比较初级,复杂程度和仿真度还不够。未来需要从细胞外基质、流体环境控制等多个芯片指标提高体系的仿真度。
第二是实现自动化。目前,很多器官芯片都是通过手动或半手动方式开发和操作,使得器官芯片目前的应用存在一定局限性。在高通量药物筛选体系下,实现器官芯片自动化是必然趋势。其中包括、芯片自动化培养、仪器自动化、自动化分析检测等。比如,美国Emulate正在开发自动化体系,还有一些公司合作进行器官芯片的三维自动化识别。
第三,器官芯片正在向无需离体检测、在线实时动态检测等方向发展。2021年4月,哈佛大学助理教授Y Shrike Zhang团队在Nature上在线发表了一项关于器官芯片的电化学生物传感器集成研究。他们将微电极功能化、生物标志物检测和传感器再生三大功能整合在一起,实现对动态指标的实时检测。
第四是实现标准化,与基因测序早期阶段相似,器官芯片正处于群雄割据的发展阶段,全球范围内尚未建立统一、完备的评判标准。标准不一样,各个芯片厂家做出的结果不同,难以比较芯片质量。未来,预计器官芯片领域会有越来越多的统一标准出来。如基因测序领域陆续推出各种标准一样,器官芯片领域将会陆续出现引领行业的公司。
当前,国内外都在建立器官芯片的标准,规范行业发展,包括欧美多家头部药企成立了非营利组织 IQ 联盟(Innovation and Quality Consortium),中国的科研机构和企业也在推进相关标准的建立。
器官芯片自动化设备
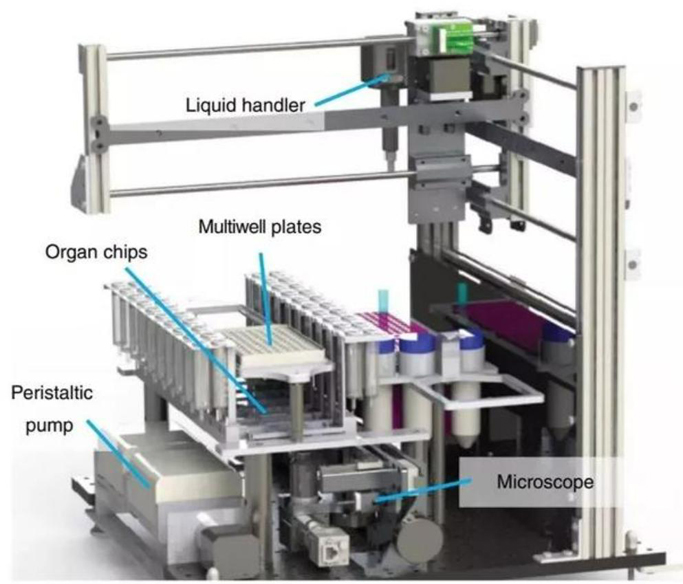
类器官多指标实时动态检测系统

图片来源:Nature、lifespan、万原点基金整理
3.3.5 器官芯片应用实例
2021年5月,中国科学院研究员司龙龙在Nature子刊发表了关于人肺气管芯片并基于该芯片模拟病毒在人肺气管中的感染和抗病毒药物治疗的文章。
传统病毒生物学和抗病毒药物临床前研究模型具有一定局限性:体外培养的细胞系或人原代上皮细胞无法反映人体器 官高度分化的组织结构和功能;人呼吸道组织的体外培养无法长时间存活、且资源稀缺;人肺类器官可以提供肺器官上皮组织,但无法实现人肺器官水平的体外重构,如缺少上皮-内皮相互作用、粘膜纤毛的清除、血流、免疫细胞的富集等,而这些生理功能在病毒感染肺的过程中具有重要作用。人肺原代细胞在 Transwell 上的培养可以支持气-液界面的形成,但其静态培养的特点无法进行临床和生理相关的药代动力学研究。动物模型与人体存在种属差异。
人肺气管芯片可以在体外更好地重构人肺气管的生理结构与功能,模拟生理环境的动态变化,为相关疾病研究和药物开发提供人生理相关的临床前研究模型。如图所示,芯片由高度分化的人肺气管上皮细胞和肺血管内皮细胞组成,上部分是空气通道,下半部分是血液通道。在空气通道引入病毒颗粒,可模拟呼吸道病毒感染;在血管通道引入免疫细胞,可研究病毒感染诱导的免疫细胞反应;此外,在空气通道或者血管通道,还可以引入药物,分析药物的抗病毒效果。
研究人员首先使用六种不同甲型流感病毒株感染器官芯片,发现细胞产生的病理变化以及不同毒株的感染强弱情况与临床结果十分类似。随后研究人员使用一线抗流感药物奥司他韦、蛋白酶抑制剂药物nafamostat和Trasylol进行治疗效果的评估,奥司他韦在器官芯片上的表现与其临床使用效果几乎一致,此外研究还发现nafamostat与奥司他韦联用还可以将奥司他韦的治疗窗口期从48小时增加到96小时。表明该器官芯片可以作为一个有用的临床前模型,用于评估在对肺部感染的潜在治疗方案。
面对COVID-19疫情大流行,该课题组开展了基于人器官芯片的抗新冠药物发现与开发研究,基于人器官芯片的潜在药物评价结果得出与后来公布的临床试验结果相似的结论,例如氯喹、羟氯喹在临床上无法有效治疗新冠;而阿莫地喹可以抑制病毒入侵宿主。该项研究的合作者西奈山伊坎医学院的Benjamin R. tenOever团队也在动物模型实验中证实了阿莫地喹的体内效果。课题组现在正在和一些公司合作,开展阿莫地喹治疗新冠的临床试验。
人体呼吸道器官芯片
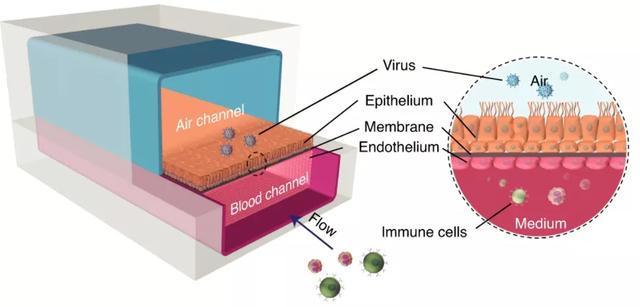
图片来源:Nature 子刊、万原点基金整理
3.4 类器官芯片技术和发展
类器官和器官芯片是独立发展的技术路线,类器官更偏向生物学,利用细胞因子诱导成体干细胞自组装形成人体微器官;而器官芯片更偏向于生物医学工程,在微流控芯片上构建人体器官生理微系统,常用的细胞类型包括人源细胞系、原代细胞和干细胞等。
类器官的优势在于高仿真性,具有与人体器官高度相似的组织学特征和功能,不过在更高仿生度、可控性、可重复性上具有局限;而器官芯片在建模的可控性和标准化上具有优势。
现有类器官技术对类器官及它们的局部环境的控制不够精确,不能很好地复制器官发展过程中复杂又动态的微环境,而这种微环境恰恰是器官形成的有利因素。为解决传统类器官技术的局限,干细胞和发育生物学领域的专家联合物理科学家和工程师们研发出更先进的体外技术,将器官芯片技术与类器官相整合形成“类器官芯片”技术。
通过两种技术的结合而产生的类器官芯片,取长补短互相补充,使得其成为更有用且更具预测性的临床前实验模型,可以广泛应用于传统或新药的研发过程;通过来源于病人的组织样本作为类器官,类器官芯片也可以创建特异性疾病模型,实现精准医疗;同时类器官芯片还可以通过高通量分析筛选体外条件优化的类器官而实现再生医学的发展。
理论上,类器官芯片整合了两种技术路线的优势,是前沿技术交叉融合的实践。2019年,Science杂志发表的综述首次提出了类器官芯片概念,类器官芯片也被视为器官芯片发展最前沿的方向之一。随着创新药的蓬勃发展,细胞治疗、mRNA等新疗法的不断涌现,传统的药物评价模型可能不再适用,为新模型和新技术的发展提供了更多机会,大橡科技即为国内类器官芯片的代表性企业。
发表于Science的类器官芯片综述
大橡科技类器官芯片产品M1

图片来源:Science、大橡科技官网、万原点基金整理
4 类器官技术的研究进展和挑战
4.1 类器官技术的最新研究进展
a.基于3D打印微流控芯片产生的血管类器官
2022年4月12日在Lab on a Chip上的一篇文献,来自鲁汶大学机械工程系生物力学科生物工程和形态发生实验室的Idris Salmon等人,开发了一种基于人类多能干细胞的方法,来产生以空间决定的方式与血管细胞相互作用的类器官。这种基于3D打印的平台旨在与任何类器官系统兼容,为理解和操纵组织特异性类器官与脉管系统的共同发展开辟新的途径。
3D打印微流体平台,用于片上血管化类器官培养物
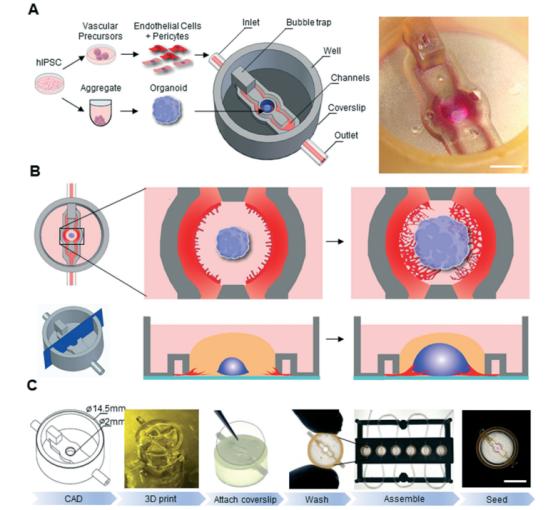
图片来源:Lab on a Chip,万原点基金整理
b.体外β细胞类器官有望为胰岛再生提供新方案
2022年4月8日发表在Nature Protocols的文献里,JingqiangWang等从成年小鼠中分离胰岛祖细胞,使功能性胰岛类器官在体外的有效生成和长期扩增成为可能。其团队通过延长培养期和循环葡萄糖刺激来实现胰岛类器官功能成熟。所得类器官主要由β细胞组成,也含有少量α、δ和胰多肽细胞。该方法为体外生成β细胞提供了一种策略,为研究胰岛再生和相关疾病提供了一个类器官模型。
体外胰岛类器官和体内类器官细胞的表征
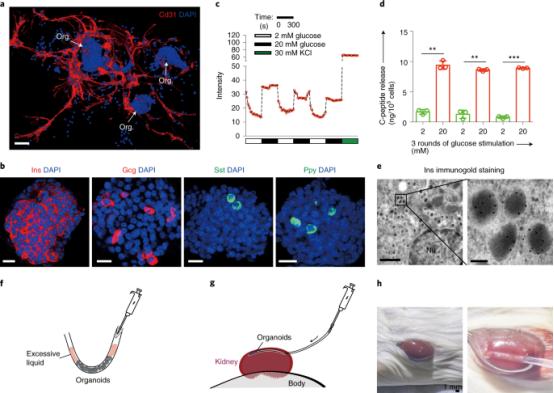
图片来源:Nature Protocols,万原点基金整理
c.大脑类器官揭示自闭症高危基因突变及后果
2022年4月5日,奥地利科学技术研究所发现自闭症高危基因的突变以及如何破坏大脑重要的发育过程,利用微型的大脑模型帮助我们理解自闭症。有别于先前使用小鼠的模式,此次研究使用大脑类器官获得巨大的进展,结论指出是CHD8突变破坏神经元生产平衡,造成患者大脑发育不全。
对照实验,突变类器官过度生长
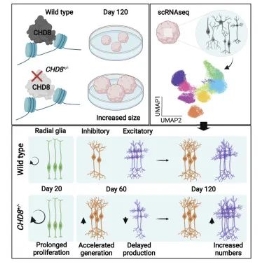
图片来源:Cell Reports,万原点基金整理
4.2 类器官技术面临的机遇和挑战
4.2.1 类器官技术面临的机遇
a.近年来,我国积极鼓励符合临床需求的真正创新性的药物开发,随着类器官技术在大型药企和新型Biotech的逐步应用和认可,未来将有更多类器官相关临床前数据的积累和申报案例,监管层有望逐步将类器官技术纳入IND/NDA审评体系和药物研究指导原则。一旦类器官技术纳入官方审评体系,该项技术在药企研发端的应用将呈现快速增长趋势。
b.在传统药物临床前研发中没有很好动物模型的领域,比如眼科药物的药理、ADME的检测等,在临床上没有明确靶点的癌种(肝癌、胃癌、胰腺癌等)的用药方案筛选中,类器官作为一项仿生度最高的体外模型,将会发挥巨大优势。同时,随着细胞治疗、基因治疗等一些新型疗法的推出,传统细胞系和动物模型可能不再适用,类器官也将会发挥其独特优势。
c.随着类器官技术研发和应用的不断深入,类器官在标准化、自动化、成本端等方面将持续优化,类器官在高仿生性的天然优势基础上,将更加符合产业化的要求,相比于传统细胞系、动物模型将在准确性、成功率、通量和成本等多方面体现出优势,并逐步替代动物模型。根据2022年5月国家药监局标管中心对于国内医疗器械分类的最新界定,类器官培养耗材已经纳入NMPA三类医疗器械管理分类,随着类器官技术和产品的进一步优化和成熟,未来类器官产品有望实现IVD化。
4.2.2 类器官技术面临的挑战
a.丰富充足的类器官库是类器官技术规模化企业服务药企的重要先决条件,目前医院和国家级人类遗传资源库类器官库是样本唯一的合法来源,虽然国内多家机构已经开始着手类器官样本库的建设,但是现有样本库里的组织有限,类器官模型目前的数量以及涵盖的癌肿远不及PDX。另外,由于类器官公司主要通过提供药敏检测获取样本,正常组织类器官存储量很有限。同时,随着科技部人遗办监管的不断加强,未来类器官样本库将会有更多政府的参与和监管。类器官企业能否持续合法合规的获取样本并建立起规模化的样本库将会是未来企业能否在竞争中胜出的关键。
b.类器官培养的两种技术路径,类器官1.0技术,优点是样本组织相对简单,可以实现更为稳定的传代,缺点是对于人体真实组织的还原性有限。类器官2.0技术,优点是模型仿生度高,可以还原体内微环境,但由于样本相对复杂,长期培养传代的难度较大。未来伴随器官芯片、类器官芯片、AI等新技术的日益成熟,业界能否推出具有高仿生度并且能够稳定传代培养的类器官模型将会是类器官行业发展的重要里程碑。
c.无论是药企临床前研发还是临床精准用药都是一个严谨的科学决策过程,尤其在药企研发领域,传统的药物研发范式和工具应用已十分成熟,企业决定采用新模型首先需要验证模型的可靠性,而且应用的过程也是一个循序渐进的过程,从早期没有成熟动物模型的研究痛点到更多更为常规的应用领域,需要较长的认知和实践周期。临床精准用药领域的应用同理,医院医生在为患者筛选最优治疗方案时,对于一项新技术,也需要该技术得到大量的数据验证的基础上并且形成一定的专家共识或者治疗指南后,才会具有较强的向患者推荐的意愿。因此类器官行业的产业化之路还有一段较长的路要走,需要行业内的企业在产品质量成本优化的基础上,将产品和服务进一步打磨完善,积累充足有效的临床数据,才有可能早日实现大规模的产业化。
5 类器官行业研究总结
从2009年Hans Clever教授团队在体外成功培养小肠类器官模型以来,类器官技术已经历10多年系统性的科研和产业化发展,从类器官1.0、类器官2.0、器官芯片以及类器官芯片已形成多种技术路线并存,临床前新药开发、临床精准用药、科研疾病机理研究等多个应用场景同时推进的发展格局。
随着国内外药物研发监管政策和评审体系对于类器官技术的开放和采纳,以及类器官相关技术的日益成熟,未来将有望实现类器官模型对于传统动物模型的补充和逐步替代。同时,在临床药物筛选方面,随着类器官技术的有效率、标准化、自动化的提升,类器官有望成为靶向药物、免疫类药物、CGT等疗法的新型伴随诊断产品。
同时,我们看到类器官行业在国内外的应用仍处于早期阶段,收入实现规模化的企业还很少,行业也缺乏统一的标准和规范,有些应用(多器官芯片、原位实时检测等)仍处于科研阶段,我们对于类器官产业的发展应理性看待,产业最终走向成熟尚需科研机构、企业、政府和资本的多方长期推动。
从团队角度来看,大橡科技、科途医学和昊佰生物均为类器官或者医药背景出身,具有一定的技术背景或产业资源,昊佰生物由于李星南的加入在类器官培养技术领域具有明显优势;科途医学具有较好的产业背景;大橡科技属于偏科研背景团队创业,背靠北大,有一定的政府和产业资源优势。
从技术角度来看,除昊佰生物外,国内大部分类器官企业是类器官1.0技术为基础,有的以类器官培养为主,有的则结合了(类)器官芯片技术。科途医学借助其原有的CDX等转化医学技术背景,走出了一条PDO+PDOX的技术路径;昊佰生物由于是国内唯一一家掌握类器官2.0技术平台的企业,目前属于是类器官2.0+类器官1.0并行的模式;大橡科技由于其为国内最早进行类器官芯片技术落地的公司,主打以类器官1.0为基础的类器官芯片技术路径;丹望和创芯目前以类器官1.0技术为主,骆华生物则以器官芯片技术为主导。
产品服务方面,目前大橡科技在产品化标准化方面处于业内领先水平,公司已相继推出3个产品系列和对应设备;昊佰生物由于其具有类器官2.0培养技术,因此在药敏检测中的免疫药物和创新疗法端具有较强应用前景,骆华生物的器官芯片结构相对复杂,目前主要应用于科研领域,其他类器官产品服务厂商有一定趋同。
从商业模式上看,目前大橡科技、科途医学主要面向药企、科研用户,昊佰生物、丹望医疗和创芯国际主要面向临床端药敏检测,骆华生物主要面向科研用户。
从融资进程来看,进展最快的为大橡科技,正在进行B轮融资,昊佰生物处于早期天使融资阶段。从既有股东来看,一线机构里目前只看到凯风创投、洪泰基金的身影,产业投资人方面目前只有药明康德之前尝试投资过大橡科技,其他药厂和CRO大多还未涉及。
综上所述,类器官技术作为新一代研究检测方法相比传统模型在药企临床前研发和临床用药方案筛选等方面具有明显优势,但该领域在国内外尚处于早期发展阶段,产业对于类器官有一定的认知度,但大规模的应用仍需要政策层面的配合和企业产品的打磨升级,由于目前类器官培养依靠人工的因素较多,未来标准化、自动化是行业的主要发展趋势,高质量、高批间一致性、低成本的类器官技术和产品将受到市场的青睐。类器官培养技术是基础,2.0代技术可以更为真实的保留组织原生态,1.0技术可以更加快速稳定的传代,两者各有优势,具体要看其所应用的场景。以器官芯片和类器官芯片为代表的的新一代类器官技术是类器官技术未来大规模产业化的方向和希望。因此,我们看好具有扎实类器官培养能力,且可以成功与微流控、AI、自动化实现有机结合的类器官企业。从基金投资的角度来看,我们判断类器官至少需要3-5年的时间实现更高水平的产业化应用并逐步打开市场,项目投资退出的周期相对较长,建议具有较强产业协同和资源整合实力的投资方择机布局。